El control de la trazabilidad de los productos sanitarios es uno de los puntos más críticos en la fabricación de estos y el que permite llevar a cabo una vigilancia sanitaria de manera más eficaz. ;
¿Qué es la trazabilidad en los productos sanitarios? ;
La correcta identificación y ;trazabilidad ;de los productos sanitarios, es una de las obligaciones de los fabricantes. Permite llevar a cabo ;un control exhaustivo, ;desde ;las materias primas, fuentes ;o reactivos con las que ha fabricado el producto, hasta donde se encuentra el producto final instalado ;o puesto en servicio. ;
Los nuevos reglamentos: ;(EU) ;2017/745 ;o ;MDR ;para producto sanitario ;y ;(EU) ;2017/746 ;o ;IVDR, ;este último para productos sanitarios de diagnóstico ;in vitro, ;ponen más énfasis en el ;control de la trazabilidad, incluyendo obligaciones para ;todos los agentes económicos ;involucrados en llegada al mercado de un producto sanitario. ;
Para ello, ;han incluido ;la obligación de identificar a los productos con un número de identificación única, o UDI (unique ;device ;Identifier). UDI ;se compone ;de una ;serie de caracteres alfanuméricos creado a partir de un estándar reconocido globalmente, (como GS1), y que permite la identificación inequívoca del producto sanitario. ;
UDI está compuesta por dos partes: ;
- UDI-DI: identificador del dispositivo, parte no variable. ;
- UDI-PI: identificador de producción, parte variable. ;

Ilustración ;1 ;ejemplo de UDI (Fuente: GS1 ;Spain) ;
Con la obligación de ;UDI ;se pretende: ;
- llevar a cabo un control de la trazabilidad más eficiente ;
- combatir la falsificación de los productos sanitarios ;
- realizar retiradas del mercado de una manera más rápida y eficaz ;
En definitiva, se trata de mejorar las acciones de vigilancia (retirada del mercado debido a acciones preventivas, o correctivas tras la detección de algún efecto adverso en pacientes o usuarios), y la protección de los pacientes y usuarios de los productos sanitarios y productos IVD. ;
Así mismo, UDI es un complemento, no un sustituto de las obligaciones y requisitos de etiquetado de los productos sanitarios. ;
Qué es el UDI-DI BÁSICO ;
Los nuevos reglamentos de producto sanitario incluyen ;además ;la obligatoriedad de un UDI-DI básico para cada producto o familia de productos. ;
Este ;UDI-DI básico es la clave de acceso principal para dispositivos relacionados ;
información en la base de datos EUDAMED ;(donde entre otras muchas funciones se deberán registrar los productos y los fabricantes) ;y aparecerá en la documentación relevante: certificados, certificado de libre venta, ;declaración UE de conformidad, documentación técnica ;y resumen de seguridad y ;funcionamiento ;(clínico) ;SSCP. ;
El propósito ;de éste es ;identificar y conectar dispositivos con el mismo ;uso previsto, clase de riesgo ;(I,IIa,IIb ;o III para producto sanitario o A,B,C o D para IVD) ;y características generales de ;diseño y fabricación. ;
Este UDI-DI Básico es ;independiente ;del etiquetado ;del producto sanitario y no aparecerá en ningún artículo comercial. ;
El etiquetado en ;los productos sanitarios ;
Los requisitos de etiquetado, excepto la obligación de UDI, no han cambiado mucho con los nuevos reglamentos y básicamente tienen que incluir: ; ;
- La denominación o nombre comercial del producto, ;
- la información estrictamente necesaria para que el usuario identifique el producto, el contenido del embalaje, y, si no es evidente para el usuario, la finalidad prevista del producto; ; ;
- el nombre, el nombre comercial registrado o la marca registrada del fabricante y su domicilio social; ; ;
- en caso de que el ;fabricante se encuentra fuera de la Unión, el nombre del representante autorizado y la dirección del domicilio social del representante autorizado; ; ;
- indicaciones específicas ;en ;el ;caso ;de productos que lleven ;una sustancia medicinal, incluidos los derivados de sangre o plasma humanos ;
- células o tejidos, o sus derivados, de origen humano ;
- células o tejidos de origen animal, o sus derivados
- cuando proceda, si contienen sustancias CRM ;
- el número de lote o el número de serie del producto
- UDI ;
- una indicación inequívoca de la fecha límite para la utilización o implantación del producto con seguridad, ;
- cuando no figure indicación de la fecha hasta la cual puede utilizarse el producto de manera segura, la fecha de fabricación. ; ;
- una indicación de cualquier condición específica de almacenamiento o manipulación que sea aplicable; ;
- si el producto se suministra estéril, una indicación de su estado estéril y el método de esterilización; ;o de su estado microbiano o de limpieza especial; ;
- advertencias o precauciones que deban ponerse inmediatamente en conocimiento del usuario del producto o de cualquier otra persona. ; ;
- si se trata de un producto de un solo uso. ;
- si se trata de un producto de un solo uso reprocesado, ; ;
- si ;se ;trata de un producto a medida ;
- si se trata de un producto destinado únicamente a investigaciones clínicas, la mención «exclusivamente para investigaciones clínicas»; ; ;
- en el caso de productos destinados a ser introducidos en el cuerpo humano por un orificio del cuerpo, o a ser aplicados en la piel que estén compuestos por sustancias que sean absorbidas por el cuerpo humano o se dispersen localmente en él, la composición cualitativa global del producto y la información cuantitativa relativa al componente o componentes esenciales responsables de lograr el efecto principal previsto; ;
- para los productos implantables activos, el número de serie y, para los demás productos implantables, el número de serie o el número de lote. ;
- si es ;el ;caso: ;la indicación de que es un producto sanitario para diagnóstico in vitro o, si se trata de un producto destinado a estudiar el funcionamiento, una indicación al respecto; ;
- una indicación del contenido neto, en peso o volumen, en número de unidades, o en una combinación de estos u otros términos que reflejen con exactitud el contenido del envase; ; ;
- si las instrucciones de uso no se facilitan en papel, una referencia a su accesibilidad (o disponibilidad) y, en su caso, la dirección del sitio web en que puedan consultarse; en su caso, las instrucciones especiales de manipulación. ;
- si el producto es para autodiagnóstico o pruebas diagnósticas en el lugar de asistencia al paciente, una indicación al respecto; ; ;
- cuando las pruebas de diagnóstico rápido no sean para autodiagnóstico o pruebas diagnósticas en el lugar de asistencia al paciente, la exclusión explícita de estos; ; ;
- en la etiqueta de los productos para autodiagnóstico deberán figurar los siguientes datos: ; ;
- el tipo de muestra o muestras necesarias para realizar el análisis (por ejemplo, sangre, orina o saliva); ;
- la necesidad de materiales adicionales para que el análisis funcione correctamente; ;
- datos de contacto para más recomendaciones y asistencia. ;Además, el nombre de los productos para autodiagnóstico no reflejará una finalidad prevista distinta de la especificada por el fabricante. ;

Ilustración 2 ;Ejemplo Etiquetado según Directivas. Fuente: Medical ;device ;stand-alone software including ;apps (including ;IVDMDs), MHRA. ;
Tal y como se puede ver en el ejemplo ;de arriba, en el etiquetado se suelen utilizar símbolos, que deben cumplir el estándar ;UNE-EN ISO 15223-1:2017 Productos sanitarios. Símbolos a utilizar en las etiquetas, el etiquetado y la información a suministrar. Parte 1: Requisitos generales. ;
Se evita de esta manera el uso de traducciones (ya que la información ;debe ;estar en el idioma del país en el cuál se ; ;introduce el producto) y la necesidad de disponer de ; diferentes etiquetados en los distintos países de la UE. ;
Tal y como se ha adelantado, UDI será obligatorio, pero la obligatoriedad de que esté impreso, o disponible en el etiquetado del producto tiene unos plazos, dependiendo de ;la clase de riesgo del producto, y se aplicarán primero a los de más alto riesgo. ;
Como conclusión, los fabricantes de producto sanitarios deben prepararse para tener el sistema UDI integrado en su organización y ;deberán contactar cuanto antes con las entidades emisoras de estos números, y que a fecha de 5 de junio de 2020 son: ;
- GS1 AISBL ;
- HealthIndustry ;Business ;Communications ;Council (HIBCC) ; ;
- International Council for Commonality in Blood Banking Automation (ICCBBA) ; ;
- Informationsstellefür ;Arzneispezialitäten ;(IFA) ;GmbH ; ;
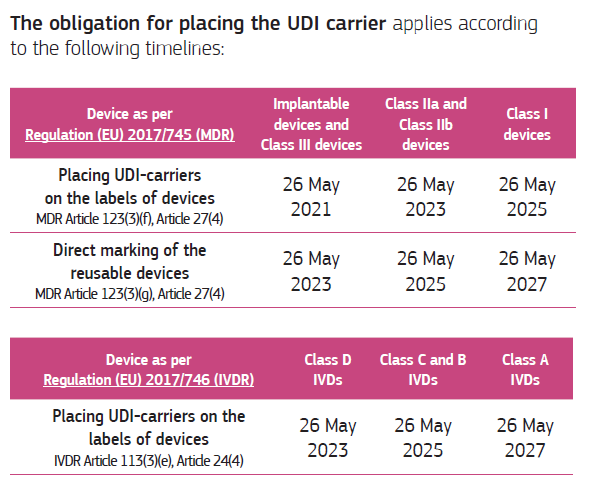
Ilustración ;3 ;Plazos de UDI en etiquetado. Fuente: FAQS UDI ;system ;(European ;Commission) ;
AMBIT BST
En AMBIT somos expertos desde hace más de 15 años en el desarrollo de estrategias y soluciones IT para tu compañía. Somos consultores e integradores en múltiples ámbitos y si quieres conocer más de las soluciones que te podemos ofrecer en el campo de la salud, no dudes en ;ponerte en contacto con nosotros.






Cuéntanos tu opinión